Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться
К сожалению, на рынке Казахстана присутствуют лекарственные средства (ЛС) и изделия медицинского назначения (здесь также «медицинские изделия» или МИ), распространяемые противозаконно, с нарушением прав потребителей, прав и коммерческих интересов владельцев товарных знаков и патентов, без должного сертифицирования и регистрации. В настоящей статье мы рассмотрим возможные нарушения и административно–правовую ответственность за реализацию незарегистрированных ЛС и МИ. При этом мы опустим тему гражданско-правовой ответственности лиц, завозящих оригинальный товар производителя без его согласия, которая рассматривалась нами ранее , в нарушение патентных прав и недобросовестной конкуренции. Рассматриваемый подход может быть использован правообладателями как дополнительное средство борьбы с нарушениями и надеемся, что эта статья поможет и добросовестным компаниям избежать случайных правонарушений, в частности, нарушений «по незнанию».

На сегодняшний день каждый вправе свободно перемещать лекарственные средства и изделия медицинского назначения через границу и внутри страны, как для личного пользования, так и в коммерческих целях. Если ввоз осуществляется с целью извлечения коммерческой выгоды, тогда лицо, которое вводит в оборот лекарства или медицинские изделия (а ввоз – это уже и есть введение в оборот), обязано учитывать правила, по которым в стране происходит его регистрация, реализация, реклама, а также знать какая может наступить ответственность в случае их нарушения.
Вопросы регистрации ЛС и МИ и ответственность за ее отсутствие достаточно хорошо регулируются законодательством Республики Казахстан, к которым в частности относятся:
- Кодекс Республики Казахстан «О здоровье народа и системе здравоохранения» (статья 71);
- Приложение № 6 к Приказу Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293;
- Приказ Министра здравоохранения и социального развития Республики Казахстан от 16 апреля 2015 года № 227 «Об утверждении Правил маркировки лекарственных средств, изделий медицинского назначения и медицинской техники»;
- Кодекс Республики Казахстан об административных правонарушениях (статья 426).
Кроме того, в рамках Евразийского Экономического Союза («ЕАЭС») и с целью выработки единообразного подхода, был принят ряд решений и правил, регулирующих порядок регистрации, маркировки ЛС и МИ, предназначенных для обращения на рынке Евразийского экономического союза. К ним относят Решение Совета Евразийской Экономической комиссии от 3.11.2016 года № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения» (далее – «Правила»).
Согласно Правилам, при регистрации ЛС и МИ, подлежащих реализации в рамках ЕАЭС, на сегодняшний день используются следующие подходы:
- процедура взаимного признания регистрации сначала в референтном государстве (то есть государстве-члене ЕАЭС, которое осуществляет подготовку отчета об оценке безопасности, эффективности и качества ЛС на основании экспертизы), а затем в любом выбранном заявителем государстве признания по требованию заявителя;
- децентрализованная процедура, в соответствии с которой регистрация производится одновременно несколькими государствами-членами ЕАЭС, в которые подано заявление о регистрации ЛС, с выбором референтного государства;
- регистрация только по национальным правилам (для рынка одного государства). Например, когда ЛС одного производителя выпущены и зарегистрированы и в России и в Казахстане, то есть по отдельности в каждом из них. Эта возможность закреплена в пункте б) статьи 2 Правил, где говорится:
«до 31 декабря 2020 г. по выбору заявителя регистрация лекарственного препарата может осуществляться либо в соответствии с Правилами, либо в соответствии с законодательством государства-члена. При этом лекарственные препараты, зарегистрированные в соответствии с законодательством государства-члена, допускаются к обращению только на территории государства-члена, уполномоченный орган которого выдал регистрационное удостоверение».
Таким образом, лица, планирующие осуществить регистрацию ЛС и/или МИ, вправе самостоятельно выбирать процедуру регистрации либо в соответствии с Правилами, либо в соответствии с законодательством государства-члена. При выборе последнего, регистрация ЛС может осуществляться по требованию заявителя последовательно в нескольких государствах-членах в соответствии с процедурой взаимного признания или одновременно в нескольких государствах-членах в соответствии с децентрализованной процедурой регистрации.
В Казахстане государство закрепляет за собой монополию по проведению экспертизы и регистрации ЛС и МИ в лице его исполнительного органа – Комитета фармации Министерства здравоохранения Республики Казахстан (далее – «Комитет фармации») и «Национального центра экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» Министерства здравоохранения Республики Казахстан (далее – НЦЭЛС). Рассмотрим подробнее процедуру регистрации лекарственного средства или медицинского изделия:
таблица 1
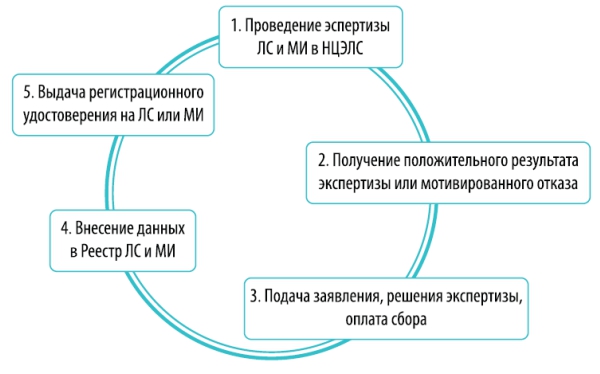
1. Проведение экспертизы лекарственных средств или медицинских изделий в НЦЭЛС, при проведении которой, НЦЭЛС:
1.1. Осуществляет оценку условий производства и системы обеспечения качества путем посещения организации производителя ЛС или МИ;
1.2. Изучает регистрационное досье, а также образцы ЛС или МИ, стандартные образцы фармацевтических субстанций (активных фармацевтических субстанций) и их примесей, в количествах, достаточных для трехкратного анализа, специфические реагенты и расходные материалы, в исключительных случаях и на условии возврата.
2. Получение заключения экспертной организации (НЦЭЛС) в виде положительного решения о выдаче регистрационного удостоверения или мотивированный отказ.
3. Подача (1) заявления от имени разработчика, производителя ЛС или МИ, или от их доверенного лица, (2) заключения экспертизы и (3) оплата сбора (сбор составит – 11 МРП, что на сегодняшний день - 27,775 тенге). Документы подаются через http://www.elicense.kz/ (что предпочтительно) или вручную, через канцелярию Комитета Фармации.
4. Внесение ЛС или МИ на определенный срок в Государственный реестр лекарственных средств и медицинских изделий (далее – «Реестр»). Этот Реестр доступен в электронном формате и открыт для общего пользования. То есть проверить наличие регистрации, и соответственно, наличие разрешения к применению лекарственного препарата или медицинского изделия может любое заинтересованное лицо.
После получения регистрационного удостоверения, лицо, которое осуществляет ввоз, может реализовывать его в рамках правового поля на территории Казахстана.
При продаже третьими лицами незарегистрированных ЛС и МИ, их действия можно считать:
(1) нарушающими запрет на реализацию незарегистрированных ЛС (ст. 67 и 69 Кодекса РК от 18 сентября 2009 года «О здоровье народа и системе здравоохранения»), согласно которому запрещается производство и оптовая и розничная реализация лекарственных средств и медицинских изделий, не прошедших государственную регистрацию в Республике Казахстан и
(2) попадающими под положения и санкции статьи 426 «Кодекса об административных правонарушениях Республики Казахстан» («КоАП РК») – «Нарушение правил фармацевтической деятельности и сферы обращения лекарственных средств и медицинских изделий» за незаконное введение в гражданский оборот незарегистрированных, не разрешенных к применению ЛС и МИ ( ч 3 ст. 426 КоАП РК):
Так, согласно ч.1 ст. 426 «Нарушение правил регистрации и перерегистрации, производства, изготовления и контроля качества, испытания (исследования), ввоза, закупки, транспортировки, хранения, маркировки, реализации, а также применения (использования), обеспечения, уничтожения, рекламы лекарственных средств, медицинских изделий, если оно не повлекло причинения вреда здоровью человека», влечет штраф на физических лиц в размере 70, на должностных лиц - в размере 100, на субъектов малого предпринимательства - в размере 130, на субъектов среднего предпринимательства - в размере 200, на субъектов крупного предпринимательства - в размере 1000 МРП. Рассматривать такие дела и налагать взыскания вправе руководитель или его заместители Комитета фармации или его территориальными подразделениями, в пределах своей компетенции.
Деяние, предусмотренное частью 1 ст. 426 КоАП, совершенное повторно в течение года после наложения административного взыскания, влечет приостановление действия лицензии на фармацевтическую деятельность сроком до шести месяцев и рассматривается уже судом.
Остановимся подробнее на ч. 3 ст. 426 КоАП РК «3. Производство, закупка, транспортировка, хранение, реализация, применение (использование), реклама незарегистрированных, не разрешенных к применению лекарственных средств и медицинских изделий, если они не повлекли причинения вреда здоровью человека, – которое влечет:
А) штраф:
|
Субъект правонарушения |
Размер штрафа |
Сумма на сегодняшний день |
|
физические лица |
100 МРП |
252 500 тенге |
|
должностные лица |
150 МРП |
378 750 тенге |
|
субъекты малого предпринимательства |
200 МРП |
505 000 тенге |
|
субъекты среднего предпринимательства |
300 МРП |
757 500 тенге |
|
субъекты крупного предпринимательства |
1500 МРП |
3 787 500 тенге |
Б) приостановление деятельности с конфискацией лекарственных и приравненных к ним средств, продуктов лечебно-профилактического питания и пищевых добавок, а также косметических средств, являющихся непосредственными предметами совершения административного правонарушения и доходов, полученных вследствие совершения административного правонарушения».
В случае если вышеуказанные действия повлекли причинение вреда здоровью человека, если эти действия не содержат признаков уголовно наказуемого деяния, ответственность увеличивается вплоть до запрещения деятельности, согласно . 4 ст. 426 КоАП.
Привлечением к административной ответственности по ч. 2, 3, 4 ст. 426 КоАП занимаются уполномоченные органы, которыми на сегодняшний день являются территориальные подразделения (Департаменты) Комитета фармации, с дальнейшим рассмотрением дела в суде.
Для привлечения к административной ответственности лиц, реализующих незарегистрированные ЛС и МИ, необходимо:
1. Заявление потерпевшего в уполномоченный орган;
2. Наличие доказательственной базы (подтверждение отсутствия регистрации ЛС, доказательства реализации и хранения незарегистрированных ЛС);
3. Возможное участие в административном производстве в качестве потерпевшего, дачи свидетельских показаний.
Обращаем внимание, что потерпевшим может признаваться любое физическое или юридическое лицо, которым административным правонарушением причинен физический, имущественный или моральный вред. Однако законодательство РК четко не определяет, какой орган или должностное лицо могут признать физическое или юридическое лицо потерпевшим от административного правонарушения. В отличие от уголовно-процессуального законодательства, КоАП РК не устанавливают специального процессуального порядка признания лица потерпевшим. Однако по смыслу ряда положений КоАП РК очевидно, что признание лица потерпевшим от административного правонарушения осуществляется судьей, органом, должностным лицом, в производстве которых находится дело.
Возбуждение административного дела может быть, в том числе, после проведение внеплановой проверки уполномоченным органом с целью выявления лекарственных средств без надлежащего оформления. Далее, согласно положениям КоАП уполномоченный орган возбуждает административное производство, составляет протокол об административном правонарушении и передает дело на рассмотрение в специализированный районный и приравненный к ним административный суд. Согласно части 1 ст. 684 КоАП РК, такие суды занимаются рассмотрением дел о привлечении к ответственности лиц, действия которых включают производство, закупку, транспортировку, хранение, реализацию, применение (использование), рекламу незарегистрированных, не разрешенных к применению лекарственных средств и медицинских изделий, если они не повлекли причинения вреда здоровью человека.
Каждому, кто каким-либо способом вводит или планирует ввести в гражданский оборот незарегистрированную лекарственную или медицинскую продукцию в Казахстане, необходимо понимать важность соблюдения процедуры ее регистрации. Помимо административных штрафов, возможности приостановления деятельности и конфискации ЛС или МИ, такое лицо может понести не только убытки, но и потерять деловую репутацию, как среди потребителей, так и среди партнеров.
Каждый производитель лекарственных средств и медицинских изделий должен быть уверен в том, что его продукция может распространяться в соответствии с правилами и нормами законодательства той страны, где оно продается. Таким образом, мы рекомендуем своевременно проверять и выявлять незарегистрированные лекарственные средства и медицинские изделия, чтобы избежать негативных последствий в будущем.
1 См. статьи про параллельный импорт на сайте https://ru.bolotovip.com/uslugi/parallelnii-import/
2 Расходы, связанные с проведением экспертизы ЛС и МИ, при их государственной регистрации несут заявители.




Комментарии
(0) Скрыть все комментарии