Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться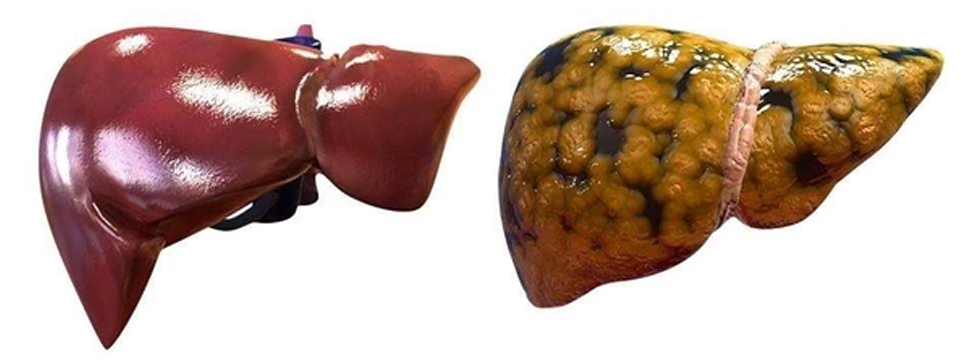
Управление по контролю качества пищевых продуктов и лекарственных средств в США (FDA) одобрило к применению препарат Rezdiffra (resmetirom, ресметиром) для лечения взрослых пациентов, страдающих неалкогольным стеатогепатитом (НАСГ) с умеренным либо значительным фиброзом печени. Препарат назначается на фоне диеты и физической нагрузки.
НАСГ является результатом прогрессирования неалкогольной жировой болезни печени (НАЖБП), когда воспалительные процессы в печени со временем приводят к рубцеванию ткани печени (фиброзу) и дисфункции печени. НАСГ часто ассоциируется с другими патологиями, такими как гипертония и диабет 2 типа. Ресметиром является частичным активатором рецептора гормона щитовидной железы, и активация данного рецептора в печени снижает разрастание жировой ткани.
Безопасность и эффективность препарата оценивались на суррогатной точке клинической эффективности 12 месяцев в ходе 54-месячного рандомизированного двойного слепого плацебо-контролируемого клинического испытания, которое на данный момент еще не завершилось.
В исследовании принимали участие пациенты, биопсия печени которых свидетельствовала о наличии воспаления вследствие неалкогольного стеатогепатита с фиброзом 2 или 3 степени. В исследовании 888 участников были рандомизированно разделены на группы для получения плацебо (294 человека), а также 80 мг или 100 мг препарата Rezdiffra (298 и 296 человек соответственно). По прошествии 12 месяцев биопсия печени показала, что у большей части пациентов, получавших Rezdiffra, наблюдалось разрешение НАСГ или уменьшение рубцевания печени по сравнению с теми, кто получал плацебо. В общей сложности у 26–27% пациентов, принимавших 80 мг препарата, и у 24–36% пациентов, принимавших 100 мг препарата, наблюдалось разрешение НАСГ и отсутствие ухудшения рубцевания печени по сравнению с 9–13 % пациентов, принимавших плацебо и получавших консультации по поводу диеты и физических упражнений.
Самые распространенные побочные эффекты препарата включали диарею и тошноту. Кроме того, Rezdiffra имеет особые предупреждения, такие как лекарственная токсичность для печени и побочные эффекты, связанные с функциями желчного пузыря. Следует избегать применения ресметирома у пациентов с декомпенсированным циррозом печени. Пациентам следует прекратить прием препарата, если во время лечения у них развиваются признаки или симптомы ухудшения функции печени.
Препарат был одобрен по ускоренной процедуре и получил статус прорывной терапии. Регистрацию препарата Rezdiffra получила фармацевтическая компания Madrigal Pharmaceuticals.
Комментарии
(0) Скрыть все комментарии